Biología y Bioquímica de Trypanosoma cruzi

Resumen
La Enfermedad de Chagas, causada por el parasito flagelado Trypanosoma cruzi, es una de las 17 Enfermedades Tropicales Desatendidas listadas por la Organización Mundial de la Salud. Es endémica en 21 países de América Latina y el número de pacientes en los países desarrollados no endémicos ha aumentado en los últimos años asociado al aumento de las migraciones. Actualmente hay entre 5 y 6 millones de personas infectadas, de las cuales menos del 1% reciben tratamiento, y se calcula que causa 7.000 muertes por año.
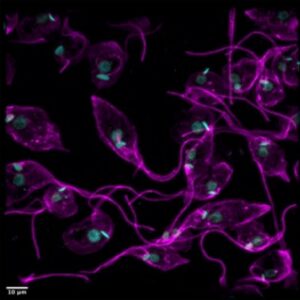
Trypanosoma cruzi, posee un ciclo de vida complejo que incluye procesos de diferenciación celular y adaptación a distintos ambientes, como el intestino del insecto vector, el citoplasma celular y el medio sanguíneo de distintos mamíferos. Las líneas de investigación desarrolladas en este laboratorio apuntan al estudio de diversos procesos relevantes en el ciclo de vida de Trypanosoma cruzi con el objetivo de encontrar nuevos blancos quimioterapéuticos contra esta enfermedad desatendida.
Líneas de Investigación
Bromodominios y proteínas acetiladas de Trypansoma cruzi
La acetilación de proteínas es una de las modificaciones postranscripcionales más frecuentes, tanto en células eucariotas como en bacterias. Si bien las bases moleculares de su acción no son completamente conocidas, se ha establecido que la acetilación modula importantes procesos celulares como la modificación de la estructura de la cromatina, la transcripción, la progresión del ciclo celular, la regulación del metabolismo energético y la remodelación de microtúbulos. En muchos casos, la acetilación genera un sitio de interacción entre proteínas, a través de un motivo de reconocimiento de lisina acetiladas denominado bromodominio (BD). Este dominio, es el único motivo estructural conocido con especificidad para reconocer y unir lisinas acetiladas y ha sido descripto exclusivamente en proteínas nucleares. Trypanosoma cruzi, tiene siete proteínas que contienen BD denominadas TcBDF1 a TcBDF7, dos de los cuales no son nucleares. El objetivo general de la línea de investigación es estudiar la existencia de proteínas con bromodominio nucleares y extranucleares en T. cruzi que participen en la modulación de diferentes eventos celulares mediados por acetilación como potenciales puntos de intervención de la biología del parásito a través del desarrollo de nuevas drogas quimioterapéuticas. En particular estamos estudiando el rol de estas proteínas y de la acetilación en la transcripción y reparación del ADN, en la dinámica del citoesqueleto y durante el proceso de infección y diferenciación. Investigador responsable: Esteban Serra | serra@ibr-conicet.gov.ar
La proteína High Mobility Group B de Trypanosoma cruzi : un componente multifuncional en la interacción parásito-hospedador en la enfermedad de Chagas
Las proteínas High mobility group B (HMGB) participan en la regulación de procesos nucleares por su capacidad de modificar la estructura de la cromatina. La HMGB1 es además una “alarmina” que se libera y alerta al sistema inmune frente a señales de peligro o daño. La HMGB de T. cruzi (TcHMGB) se expresa en todo el ciclo de vida del parásito, variando en concordancia con los cambios en la estructura de la cromatina y las tasas de replicación y transcripción. Su sobreexpresión afecta el crecimiento y la infectividad del parásito. Nuestra hipótesis es que TcHMGB contrubuye al establecimiento de regiones de cromatina “relajada” afectando la accesibilidad del ADN y regulando así la transcripción, la replicación o la reparación del ADN. Por otra parte, observamos que TcHMGB es capaz de estimular la producción de mediadores inflamatorios como su ortóloga humana y puede ser secretada por los distintos estadios del parásito, por lo que podría tener un rol en la inmunidad frente a la infección por T. cruzi. El objetivo de esta línea es estudiar los posibles roles de TcHMGB, tanto en la regulación de las funciones nucleares como en su interacción con el sistema inmune del hospedador vertebrado. Investigador responsable: Dra. Pamela Cribb | cribb@ibr-conicet.gov.ar
Publicaciones Seleccionadas
- Essential Bromodomain TcBDF2 as a Drug Target against Chagas Disease. ACS Infectious Diseases. Pezza, A., Tavernelli, L. E., Alonso, V. L., Perdomo, V., Gabarro, R., Prinjha, R., Rodríguez Araya, E., Rioja, I., Docampo, R., Calderón, F., Martin, J., & Serra, E. (2022). https://doi.org/10.1021/acsinfecdis.2c00057
- Alpha-Tubulin Acetylation in Trypanosoma cruzi: A Dynamic Instability of Microtubules Is Required for Replication and Cell Cycle Progression. Frontiers in Cellular and Infection Microbiology, 11.Alonso, V. L., Carloni, M. E., Gonçalves, C. S., Martinez Peralta, G., Chesta, M. E., Pezza, A., Tavernelli, L. E., Motta, M. C. M., & Serra, E. (2021). https://doi.org/10.3389/fcimb.2021.642271
- A new model for Trypanosoma cruzi heme homeostasis depends on modulation of TcHTE protein expression. Journal of Biological Chemistry, 295(38), 13202–13212. Pagura, L., Tevere, E., Merli, M. L., & Cricco, J. A. (2020). https://doi.org/10.1074/JBC.RA120.014574/ATTACHMENT/568AFFF2-548A-45D4-91E2-38D15903E899/MMC1.PDF
- Overexpression of Trypanosoma cruzi High Mobility Group B protein (TcHMGB) alters the nuclear structure, impairs cytokinesis and reduces the parasite infectivity. Scientific Reports, 9(1).Tavernelli, L. E., Motta, M. C. M., Gonçalves, C. S., da Silva, M. S., Elias, M. C., Alonso, V. L., Serra, E., & Cribb, P. (2019). https://doi.org/10.1038/s41598-018-36718-0
- Discovery of a Biologically Active Bromodomain Inhibitor by Target-Directed Dynamic Combinatorial Chemistry. ACS Medicinal Chemistry Letters, 9(10). García, P., Alonso, V. L., Serra, E., Escalante, A. M., & Furlan, R. L. E. (2018). https://doi.org/10.1021/acsmedchemlett.8b00247
- Heme A synthesis and CcO activity are essential for Trypanosoma cruzi infectivity and replication. Biochemical Journal, 474(14), 2315–2332. Merli, M. L., Cirulli, B. A., Menéndez-Bravo, S. M., & Cricco, J. A. (2017). https://doi.org/10.1042/BCJ20170084
- Trypanosoma cruzi High Mobility Group B (TcHMGB) can act as an inflammatory mediator on mammalian cells. PLoS Neglected Tropical Diseases, 11(2). Cribb, P., Perdomo, V., Alonso, V. L., Manarin, R., Barrios-Payán, J., Marquina-Castillo, B., Tavernelli, L., & Hernández-Pando, R. (2017). https://doi.org/10.1371/journal.pntd.0005350
- The Trypanosoma cruzi Protein TcHTE Is Critical for Heme Uptake. PLOS Neglected Tropical Diseases, 10(1), e0004359. Merli, M. L., Pagura, L., Hernández, J., Barisón, M. J., Pral, E. M. F., Silber, A. M., & Cricco, J. A. (2016). https://doi.org/10.1371/JOURNAL.PNTD.0004359
- Glycosomal bromodomain factor 1 from Trypanosoma cruzi enhances trypomastigote cell infection and intracellular amastigote growth. Biochemical Journal, 473(1). Ritagliati, C., Villanova, G. V., Alonso, V. L., Zuma, A. A., Cribb, P., Motta, M. C. M., & Serra, E. C. (2016). https://doi.org/10.1042/BJ20150986
- Overexpression of bromodomain factor 3 in Trypanosoma cruzi (TcBDF3) affects differentiation of the parasite and protects it against bromodomain inhibitors. FEBS Journal, 283(11). Alonso, V. L., Ritagliati, C., Cribb, P., Cricco, J. A., & Serra, E. C. (2016). https://doi.org/10.1111/febs.13719
For a complete list, check the lab Research Gate Profile: https://www.researchgate.net/lab/Laboratorio-de-Biologia-y-Bioquimica-de-Trypanosoma-cruzi-IBR-CONICET-Esteban-Serra
Twitter: @TcruziIBR
IG: @tcruzi_ibr